信号转导通路
一、G蛋白耦联受体介导的信号转导通路
G蛋白耦联受体(GPCR)是细胞膜受体中的最大家族,所有真核细胞均使用G蛋白耦联受体,其不仅介导大多数来自环境信号的刺激,也可介导细胞之间的信号传递,包括激素、神经递质和局部化学介质。
人类的视觉、嗅觉和味觉(酸味除外)均依赖于G蛋白耦联受体介导的信号转导通路。信号分子(配体)与G蛋白耦联受体结合后,激活G蛋白,启动不同的信号转导通路,产生各种生物学效应。G蛋白的下游效应蛋白比较复杂,主要是离子通道或与膜结合的酶包括腺苷酸环化酶、磷脂酶C、磷脂酶A2及磷酸二酯酶。 #生化
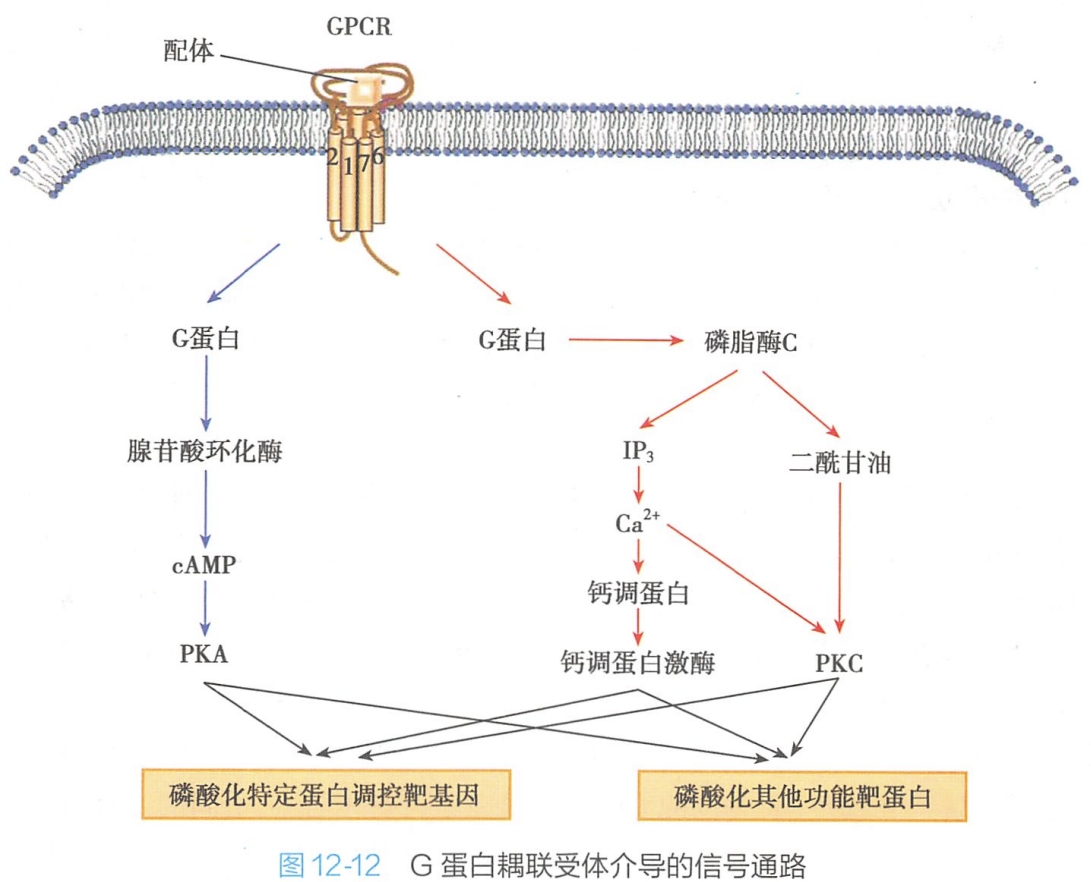
一般认为以离子通道为效应蛋白的配体-受体作用(G蛋白效应)快速而短暂,而以酶分子为效应蛋白的配体-受体作用(G蛋白效应)缓慢而持久。
细胞内的信号转导通路对细胞有两种效应:
- 短期效应:几秒到几分钟,对于已经存在的酶或蛋白质的活性进行调节,从而引起细胞代谢或功能的改变,大多数G蛋白耦联受体介导的信号通路属于这一类;
- 长期效应:数小时到数分钟,有一些G蛋白耦联受体主要通过激活或抑制基因转录引起细胞增殖或向不同类型的细胞进行分化,这类受体介导的信号通路具有长期效应。
(一)G蛋白耦联受体介导腺苷酸环化酶信号通路
第一信使-G蛋白耦联受体-G蛋白-AC-cAMP-PKA-效应蛋白
在腺苷酸环化酶信号通路中,信号分子与G蛋白受体结合后,Gα亚基的首要效应是腺苷酸环化酶(adenylate cyclase,AC),通过AC活性的变化,调节靶细胞内第二信使cAMP的水平,进而影响信号通路的下游事件。
AC可以催化ATP分解形成cAMP,cAMP的主要作用是激活cAMP依赖性蛋白激酶A(PKA),进而使下游靶蛋白磷酸化,从而调节细胞的新陈代谢。
信号分子通常是激素,如胰高血糖素、肾上腺素及去甲肾上腺素等。以肾上腺素为例介绍G蛋白耦联受体介导的腺苷酸环化酶信号通路。肾上腺素的主要功能是调节糖代谢,促进肝糖原和肌糖原的分解,增加血糖和血中乳酸含量。 #生理
肾上腺素由肾上腺分泌后通过血液到达肝细胞,与肝细胞膜表面的肾上腺素受体结合,肾上腺素受体分为α及β两个类型。受体与肾上腺素结合后,促进耦联三联体G蛋白构象改变,形成具有活性的GTP-Gsα,而GTP-Gsα激活腺苷酸环化酶,催化ATP环化形成cAMP,激活cAMP依赖性蛋白激酶A,启动下游信号通路。通过级联反应,肾上腺素与受体结合后可以在极短的时间内使磷酸化酶的活性达到最大值。
依赖cAMP的蛋白激酶A在不同的组织中作用的底物不同,cAMP通过活化或抑制不同的酶系统,使细胞对外界不同的信号产生不同的反应。例如,在肝脏和肌肉组织中,肾上腺素通过对这两种细胞中合成和降解糖原的酶的调控来调控糖代谢过程;而在脂肪细胞中,肾上腺素通过激活PKA促进磷脂酶的磷酸化,磷酸化的磷脂酶可水解甘油三酯,产生甘油和游离的脂肪酸分子,脂肪酸释放到血液中,被其他组织摄取,为其提供能量。 #?
(二)G蛋白耦联受体介导磷脂酰肌醇信号转导通路
第一信使-G蛋白耦联受体-G蛋白-PLC-IP3-Ca2+(负反馈)-效应蛋白
第一信使-G蛋白耦联受体-G蛋白-PLC-DAG(+Ca2++PS)-PKC-效应蛋白
第一信使-G蛋白耦联受体-G蛋白-PLC同工酶-IP3-Ca2+-CaM复合物-效应蛋白
磷脂酰肌醇信号通路中细胞外的信号分子与细胞表面G蛋白耦联型受体结合,通过膜上特定的G蛋白激活磷脂酶C(phospholipase C,PLC),使细胞膜上的4,5-二磷脂酰肌醇(PIP2)水解成1,4,5-三磷酸肌醇(IP3)和二酰基甘油(DAG)两个重要的细胞内第二信使,细胞外信号转换为细胞内信号,(IP3扩散入细胞质中,DAG仍继续留在细胞膜中,这一信号系统又称为“双信使系统”(double messenger system)
1.IP3动员细胞内质网中Ca2+的释放,使胞内Ca2+浓度升高
IP3是一种水溶性分子,产生后即可从细胞膜扩散至细胞质,与内质网膜上的受体结合,致使内质网膜上的Ca2+通道开放,Ca2+从内质网释放入细胞质,启动细胞内Ca2+信号系统,引发多种细胞反应。
细胞内大部分Ca2+储存在线粒体和内质网腔及其他细胞小囊中,细胞质中Ca2+浓度通常在极低水平,细胞质中Ca2+浓度的轻微升高即能诱导多种细胞反应。细胞内Ca2+的水平是经过精确调控的。
当细胞外液中缺乏Ca2+时,肝脏及脂肪等组织细胞表面的受体与相关激素结合后通过IP3诱导细胞质中Ca2+水平升高。
负反馈:细胞质中低浓度的Ca2+能够提高细胞中通道受体与IP3之间的结合力,从而增强IP3门控的Ca2+通道的开放,导致储备的Ca2+进一步释放;然而,细胞质中如果存在高浓度的Ca2+,通道受体与IP3之间的结合力却降低,进而抑制IP3诱导的细胞内储备Ca2+的释放。
2.DAG在Ca2+的协同下激活蛋白激酶C
脂溶性的DAG生成后仍留于细胞膜上,在有Ca2+、磷脂酰丝氨酸存在的情况下,激活蛋白激酶C(protein kinase C,PKC)。
PKC是单一肽链的蛋白质,在未受外界信号刺激的细胞中主要分布在细胞质中、呈非活性结构;当细胞质中Ca2+水平升高时PKC结合至细胞膜的胞质面、受到DAG的作用而活化。因此PKC的激活依赖于Ca2+和DAG水平的升高,说明IP3/DAG通路之间相互交叉。
3.Ca2+-CaM复合物介导多种细胞反应
细胞外的信号分子除了能与G蛋白耦联受体结合外,还能与其他几种受体结合激活PLC的同工酶,导致IP3介导的细胞质中Ca2+水平的升高,直接活化一些转录因子。其中的机制为Ca2+与CaM形成复合物既能通过激活蛋白酶使得一些转录因子磷酸化,也能激活一些磷酸酶使另外一些转录因子的磷酸基团解离,从而改变这些转录因子的活性,进而调控基因的转录。
在一些特殊类型的细胞中,这些细胞质中游离的Ca2+是重要的第二信使,对细胞功能的影响举足轻重。
(三)G蛋白耦联受体调控离子通道
许多神经递质受体如谷氨酸和5-羟色胺受体是配体门控离子通道,但也有一些神经递质受体是G蛋白耦联受体。
其中一些受体的G蛋白的效应蛋白是Na+或K+通道,当神经递质与这些受体结合后引起相关离子通道的开启或关闭,导致细胞膜电位的改变。(配体门控离子通道多加一个步骤)
鼻腔中的嗅神经受体、眼睛中的光感受器也属于G蛋白耦联受体,它们是通过激活细胞内第二信使间接调节离子通道的活性。(配体门控离子通道多加两个步骤)
二、具有酶活性受体介导的信号转导通路
像G蛋白耦联受体(GPCR)一样,具有酶活性的受体也是跨膜蛋白,具有与配体结合的胞外结构域,但与GPCR不同的是,酶活性受体通常是单次跨膜,其胞内部分具有酶的催化活性。这类受体主要包括酪氨酸蛋白激酶受体、丝氨酸/苏氨酸蛋白激酶受体、鸟苷酸环化酶受体和酪氨酸磷酸酶受体等。
(一)Ras蛋白是酪氨酸蛋白激酶受体介导的信号通路中的关键组分
第一信使-TPKR(-GRB2)-Ras-MAPK信号通路
第一信使-TPKR-PLC-IP3-Ca2+(负反馈)-效应蛋白
第一信使-TPKR-PLC-DAG(+Ca2++PS)-PKC-效应蛋白
大多数酪氨酸蛋白激酶受体(TPKR)以单体形式存在于细胞膜上,当配体与TPKR结合后,能导致受体二聚体化,从而激活TPKR的酪氨酸激酶活性,使受体胞内段的酪氨酸残基发生磷酸化。
磷酸化的酪氨酸残基可以与含有SH2结构域的蛋白质分子结合,启动下游信号转导。其中一种蛋白是生长因子受体结合蛋白2(growth factor receptor-bound protein2,GRB2),其能耦联活化的受体和其他信号蛋白,参与诸如Ras-MAPK信号通路中;另一种蛋白是GPCR信号通路中的PLC,其下游的信号均与GPCR-PLC通路完全一致。
在真核细胞中,Ras蛋白是TPKR介导的信号通路中的一种关键组分。Ras蛋白是一种GTP结合蛋白,具有GTPase活性,Ras-GTP是其活化形式而Ras-GDP是其失活形式。原癌基因包括src、ras、sis、myc、myb等基因家族成员
(二)PI3K-Akt信号通路是酪氨酸蛋白激酶受体介导的经典信号通路
第一信使-TPKR-PI3K-PI-3,4,5-P3-PDK1+Akt(+mTOR)-活化Akt
在TPKR介导的信号通路中,与TPKR受体结合的另一个重要分子是磷脂酰肌醇-3-激酶(PI3K)。
PI3K是一种细胞膜结合酶,其不仅具有丝氨酸/苏氨酸激酶活性,还具有磷脂酰肌醇激酶活性,能使细胞膜上的磷脂酰肌醇发生磷酸化,磷酸化的磷脂酰肌醇是许多蛋白激酶的锚定位点,可活化下游的蛋白激酶,启动下游的信号通路。
其中一条最典型的下游信号通路是PI3K-Akt信号通路。在PI3K-Akt信号通路中,当PI3K被TPKR激活后能够磷酸化PI-4,5-P2生成PI-3,4,5-P3,PI-3,4,5-P3能够招募具有PH结构域的PDK1(磷脂酰肌醇依赖性激酶1)和Akt转位到细胞膜上。随后 PDK1磷酸化Akt活性位点上的苏氨酸,胞质内的mTOR磷酸化Akt上的丝氨酸位点,使Akt完全活化,活化的Akt从细胞膜中解离进入细胞质和细胞核,进一步调控下游靶蛋白,产生生物学效应。
(三)TGF-β受体信号通路通过Smad将细胞外信号转导到细胞核内
TGF-β-TGF-β受体(R3-R2+R1-活化R1)-R-Smad-R-Smad+Smad4
转化生长因子-β(transforming growth factor-β,TGF-β)家族是一类在结构上相似的分泌型多肽生长因子,有近30种成员,包括TGF-β、BMP(bone morphogenetic protein)、activin等多个亚家族。
TGF-β家族分子在合成后被分泌到细胞外,其活性形式大多为二聚体。TGF-β受体的胞内段均含有丝氨酸/苏氨酸酶结构域,根据分子量大小可分为RⅠ、RⅡ和RⅢ受体3类。其中RⅢ受体负责结合和富集成熟的TGF-β,RⅠ和RⅡ受体为二聚体化的跨膜蛋白,直接参与信号转导。
- 每种TGF-β信号分子与相应的RⅡ结合后,
- RⅡ进一步招募RⅠ受体并与之结合,形成四聚体,从而将激酶结构域靠近,
- RⅡ受体磷酸化RⅠ受体胞内段的丝氨酸/苏氨酸残基,激活RⅠ受体。
- 活化的RⅠ受体直接结合并磷酸化下游的基因调节蛋白Smad家族(图12-l3)。
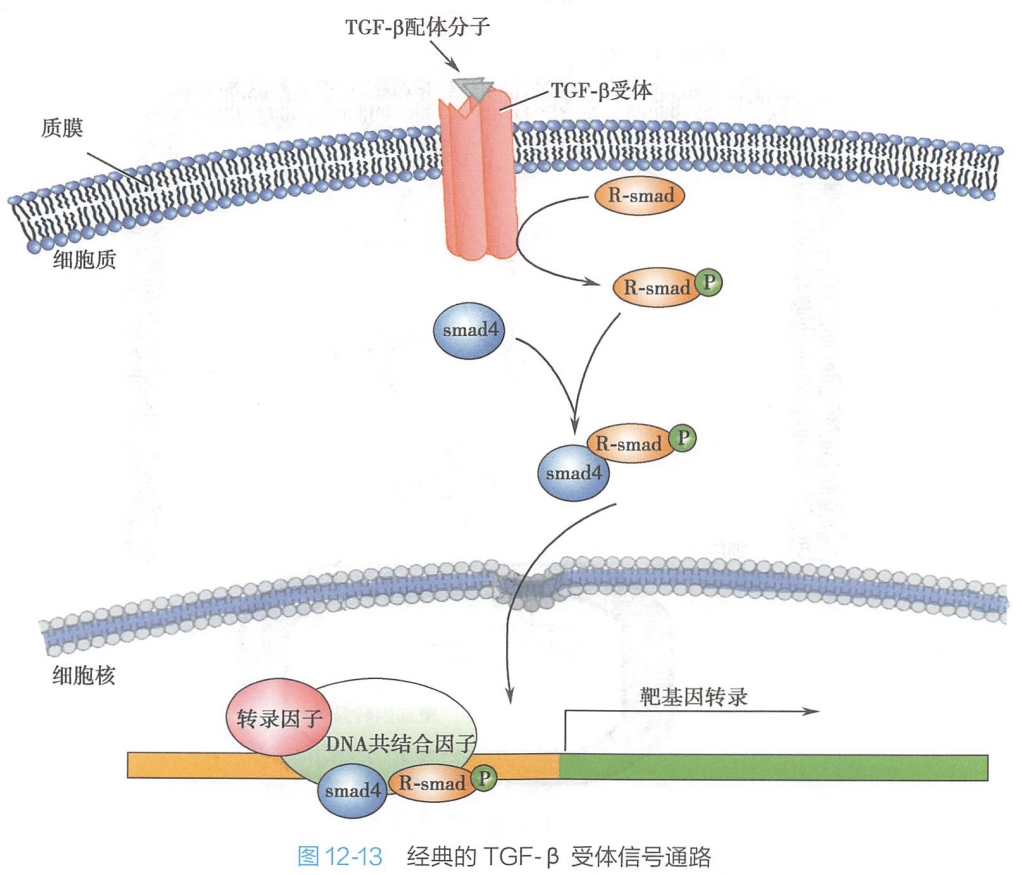
Smad分子作为细胞内信号分子,将细胞外的TGF-β信号转导到细胞核内。根据功能不同,细胞内的Smad分子分为三类,即
- 受体激活型Smad(R-Smad,包括Smad1/2/3/5/8)、
- 通用型Smad(Smad4)
- 抑制型Smad(Smad6/7)。
TGF-β与细胞表面的受体结合,使受体活化,活化的受体进一步磷酸化细胞内的R-Smad分子。磷酸化的R-Smad分子在细胞质内与Smad4组成复合体,转运到细胞核,发挥转录因子的作用,调控下游靶基因的表达。Smad分子由MH1和MH2两个结构域以及连接它们的铰链区组成,MH1结构域具有DNA结合能力,MH2结构域可与多种其他转录因子相互作用。
由于细胞的生理状态和分化情况不同,在不同的细胞中相同的TGF-β信号可以引起截然相反的调节作用。TGF-β还可以激活包括MAPK信号通路在内的其他信号通路,共同调节细胞的生命活动。
三、酶连接受体介导的信号转导通路
与具有酶活性的受体一样,酶连接受体也是跨膜蛋白,但通常是单次跨膜,它们本身不具有酶的催化活性,而是直接与酶相关联。
细胞因子受体即属于此类受体。细胞因子受体介导的信号转导通路在机体的许多生理反应中发挥着重要的调控作用。
细胞因子是由细胞分泌并作用于其他细胞的一类小分子蛋白,能调控细胞的增殖及分化等行为,包括白介素(interleukin,IL)、干扰素(interferon,IFN)和促红细胞生成素(erythropoietin,Epo)等。
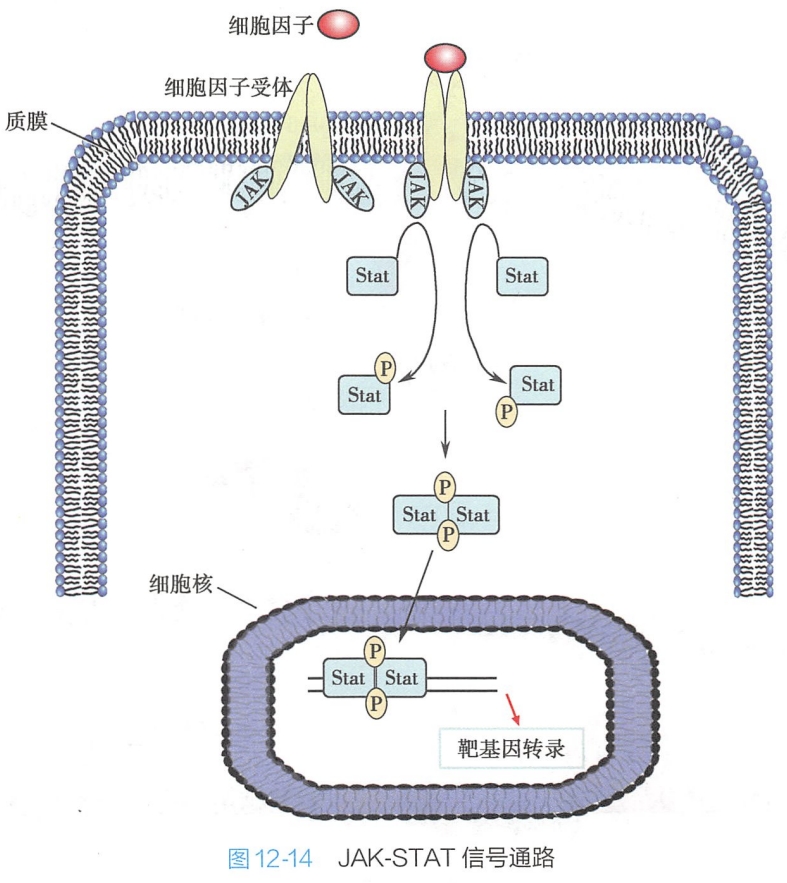
细胞因子受体的胞内段与细胞质酪氨酸激酶(Janus kinase,JAK)稳定结合,JAK家族包括4个家族成员JAK1、JAK2、 JAK3和Tyk2。JAK能磷酸化并活化STAT(signal transducers and activation of transcription)基因调控蛋白。STAT家族包含7个成员,存在于细胞质中,并且仅在被激活时才会迁移入细胞核,进一步调控下游基因表达(图12-14)。
四、蛋白质水解相关的信号转导通路
除了前面提到的信号转导通路外,生物个体内还存在一系列可控性的蛋白水解相关信号通路,一类为泛素化降解介导的信号通路如Wnt、Hedgehog和NF-κB等信号通路,另一类是蛋白切割(cleavage)介导的信号通路如Notch等信号通路。
(一)泛素化降解介导Wnt、Hedgehog和NF-κB等信号通路
1.Wnt信号通路中β-catenin扮演转录激活因子和膜骨架连接蛋白的双重角色
Wnt信号通路在个体的发育过程中发挥重要作用,但Wnt信号通路的过度活化或失活均会导致疾病或肿瘤的发生。Wnt信号通路有两种细胞表面受体蛋白:
- Frizzled(Fz):含有7次跨膜a螺旋,能直接与Wnt结合;
- 共受体LRP:以Wnt信号依赖的方式与Fz受体结合。
当没有Wnt信号时,细胞膜上的β-catenin发挥连接蛋白的作用,细胞质中的β-catenin结合由支架蛋白Axin介导的包含APC等蛋白的降解复合物。静息状态下,复合物中的两个激酶CK1和GSK3能磷酸化β-catenin。随后β-catenin中被磷酸化的一些基团招募泛素化连接酶TrCP,泛素化的β-catenin最终被26S蛋白酶体降解。细胞质内仅有低水平的β-catenin,无法进入细胞核激活下游基因。 #?
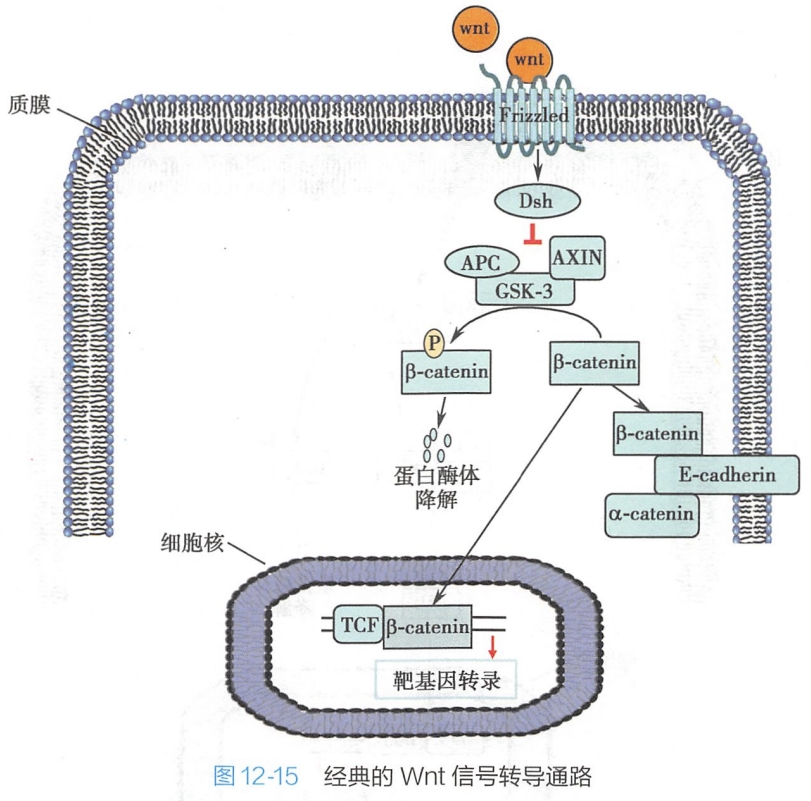
当细胞外存在高水平的Wnt信号时,Wnt与细胞膜表面受体Fz和LRP结合,磷酸化LRP受体的胞质结构域。复合物中的支架蛋白Axin结合到LRP磷酸化的胞质结构域,同时释放出CK1和GSK3,导致β-catenin无法被GSK3和CK1磷酸化。因此,β-catenin不会被泛素化降解,在胞质中维持稳定。在这个过程中,还需要Dishevelled(Dsh)蛋白结合到Frizzled受体的胞内结构域以帮助游离的β-catenin维持稳定。游离的β-catenin进入细胞核,结合转录因子TCF并作为共激活子诱导下游靶基因的表达(图12-15)。
2.Hedgehog信号通路通过Ci/Gli转录因子将信号转入细胞核
Hedgehog信号通路在胚胎发育过程中的异常可导致严重的发育异常或畸形,而且Hedgehog信号通路的异常激活与多种肿瘤的发生相关。
Hedgehog(Hh)为分泌型蛋白,作用范围一般为1~20个细胞,扩散距离越远,浓度越低。不同浓度的Hh信号对靶细胞的效应不同,其产生受时间和空间的严格调控。
Hh信号分子有两种膜受体:Smoothened(Smo)和Patched(Ptc)。Smo是7次跨膜蛋白,Ptc是12次跨膜蛋白。在Hh信号不存在时,Ptc主要富集于细胞膜上,将Smo限制在细胞内膜泡中。
Hh信号通路胞内蛋白复合物包含 Fused(Fu)、Costal-2(Cos2)和Cubitis interuptus(Ci)蛋白,该复合物在细胞内主要结合在微管上。复合物中的转录因子Ci(脊椎动物中对应的同源基因为Gli)能被3种蛋白激酶磷酸化,磷酸化的Ci在泛素化连接酶和蛋白酶体作用下水解为Ci75片段,Ci75进入细胞核抑制下游靶基因的表达。
当Hh信号与细胞膜上的PtC受体结合后,Ptc的活性被抑制并诱发内吞被溶酶体消化,从而解除了Ptc对Smo的限制作用,使Smo通过膜泡融合移位至质膜上并被CK1和PKA两种激酶磷酸化。Fu和Cos2的磷酸化水平上升导致Fu/Cos2/Ci复合物从微管上解离下来。Cos2携带Fu结合到Smo的C端,Ci形成稳定形式并进入细胞核内与转录激活子CREB结合蛋白(CBP)结合,促进靶基因的表达。
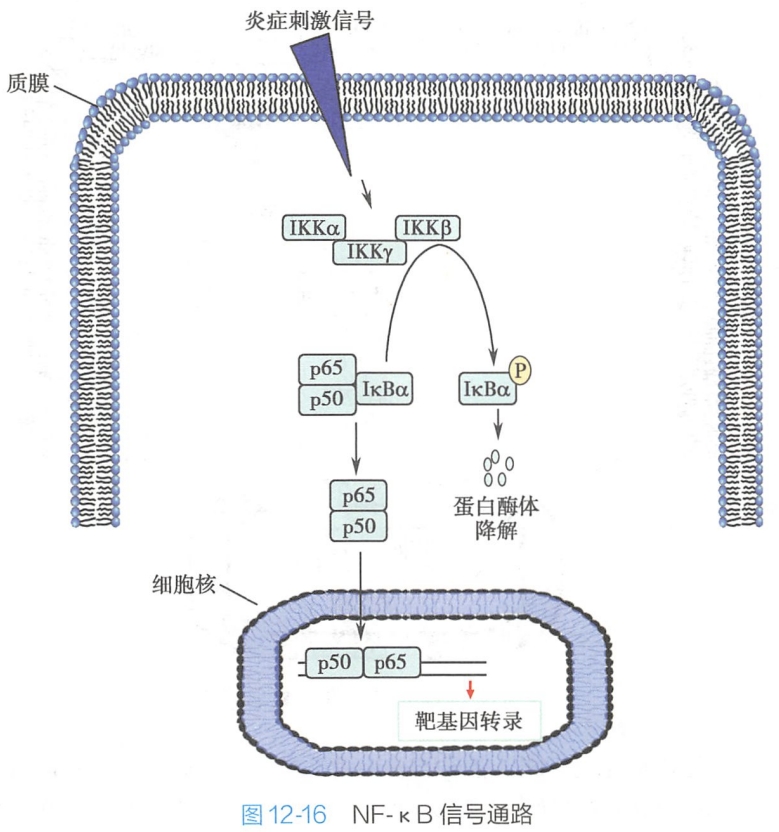
3.IκBa泛素化降解激活NF-κB信号通路
核因子κB(nuclear factor-kappa B,NF-κB)是哺乳动物免疫系统的主要转录调控因子,能促进中性粒细胞迁移到炎症组织,也能在细菌刺激下诱导iNOS(诱导型一氧化氮合酶)的表达,以及产生一些抗凋亡蛋白抵抗细胞死亡。
NF-κB信号通路的受体主要包括TNF α受体、Toll样受体和IL-1受体。 #免疫 组成NF-κB异二聚体的p50和p65两个亚基通过其N端的同源区形成二聚体并与DNA结合。在细胞没有应急或感染的静息状态下,NF-κB和其抑制子IκB(inhibitors of of NF-κB)α结合处于失活状态。单分子IκBα结合到p50和p65异二聚体的N端同源区,核定位序列被隐藏。
细胞在感染源或炎症细胞因子的短时间刺激下,胞内异三聚体复合物IκB激酶中的IKK β亚基激活并被磷酸化。活化的IKK β亚基进一步磷酸化IκBα N端的丝氨酸残基,E3泛素化连接酶结合到这些磷酸丝氨酸位点对IκBα进行多泛素化修饰并诱导其被蛋白酶体降解。IκBα降解后,NF-κB的抑制被解除,其上的核定位序列暴露,引导NF-κB进入细胞核激活靶基因的转录(图12-16)
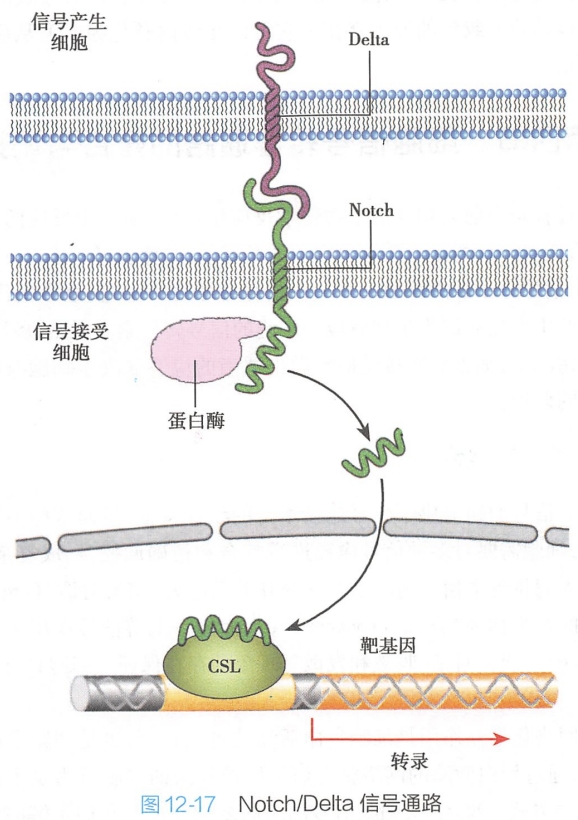
(二)通过蛋白切割(cleavage)激活Notch信号通路
在Notch信号通路中,受体是Notch,与其对应的配体是Delta,两者皆是位于细胞膜表面的单次跨膜蛋白。一个细胞上的Delta与邻近细胞上的Notch受体结合,Notch被激活,其胞外部分首先被MMP家族蛋白ADAM10切割,释放Notch受体的胞外段。随后γ-secretase四蛋白复合体中的nicastrin亚基结合到Notch被切割后的残余部分,复合体中的蛋白酶Presenilin 1催化膜内切割并释放Notch胞质片段。Notch胞质片段进入细胞核与转录因子相互作用影响基因表达(图12-17)。
五、细胞内受体介导的信号转导通路
细胞内受体的配体大多为脂溶性小分子,它们可以透过细胞膜,进入细胞与细胞内受体结合而传递信号。
(一)甾体类激素通过细胞内核受体介导基因表达调控
如前面所述,核受体的配体主要是类固醇激素、甲状腺激素、视黄酸及维生素D3等脂溶性小分子甾体类激素。
这些小分子进入细胞内,与其特异性的核受体结合改变其构象从而激活受体。被激活的受体与DNA上的受体结合元件结合,影响基因转录,从而调节生物体内平衡。甾体类激素诱导的基因活化分为两个阶段:
- 直接活化少数特殊基因转录的初级反应阶段,发生迅速;
- 初级反应的基因产物再活化其他基因产生延迟的次级反应,对初级反应起放大作用。
(二)NO以自由基的形式(NO·)介导细胞独特的信号通路
NO(nitric oxide, NO)在心血管系统中起信号分子作用。NO以自由基的形式(NO·)介导细胞独特的信号通路。NO可以快速地通过细胞膜,实现细胞与细胞间的弥散,使血管平滑肌舒张或作为神经递质传递信号。
NO的半衰期很短,在细胞外极不稳定,只能在组织中局部扩散,它的生成需要一氧化氮合成酶的催化。一氧化氮合酶(nitric oxide synthase,NOS)催化L-精氨酸和氧分子,分解合成瓜氨酸和NO。 #生化
在运动过程中,刺激骨骼肌收缩的Ca2+反复释放,Ca2+与CaM结合,并激活NOS生成NO,NO弥散出骨骼肌,进入围绕血管壁的平滑肌细胞。NO的主要受体是可溶性的鸟苷酸环化酶,NO与鸟苷酸环化酶血红素基团中铁可逆性结合,引发其构象改变从而激活鸟苷酸环化酶,生成cGMP,而cGMP通过cGMP依赖的蛋白激酶G的活化从而使血管舒张。
硝酸甘油可以治疗心绞痛的原因就在于它可以在体内转化为NO,从而使血管舒张,减轻心脏负荷和心肌的缺氧量。